Por Mario Iván B. Ruiz
-Investigadores de la ESM bloquean el gen de la proteína involucrada en la proliferación de vasos sanguíneos anormales que conllevan a la pérdida de la visión
-El doctor Santiago Villafaña Rauda explicó que en las personas diabéticas disminuye la capacidad de los vasos para transportar oxígeno a la retina
Coneme / Mediante técnicas de silenciamiento génico, investigadores del Instituto Politécnico Nacional (IPN) liderados por el doctor Santiago Villafaña Rauda, buscan reducir los índices de ceguera causada por retinopatía diabética, para ello usan Ácido Ribonucleico de interferencia o ARN pequeño de interferencia (siRNA por sus siglas en inglés) para bloquear un gen de la proteína involucrada en la proliferación de vasos sanguíneos anormales (neovasos) que conllevan a la pérdida de la visión.
El experto en farmacología y silenciamiento génico de la Escuela Superior de Medicina (ESM) explicó que en las personas diabéticas disminuye la capacidad de los vasos para transportar oxígeno a la retina, por lo que para compensar esa hipoxia se genera una sobreexpresión de la proteína Angiopoyetina 2, la cual contribuye a la generación desregulada de neovasos, cuyas ramificaciones se extienden en esa capa interna del globo ocular y causan ceguera.
El científico politécnico detalló que han comprobado en modelos animales que la terapia basada en ARN de interferencia disminuye la formación de nuevos vasos, por lo que se profundizarán los estudios y al concluirlos buscarán los mecanismos para pasar a la etapa clínica y evaluar sus efectos en pacientes con diabetes, inclusive aquellos que tienen retinopatía avanzada. “Si los avances continúan como hasta ahora, esta terapia podría constituir en un futuro un tratamiento viable para evitar que sigan aumentando los índices de retinopatía diabética y, por ende, de ceguera”, acotó.
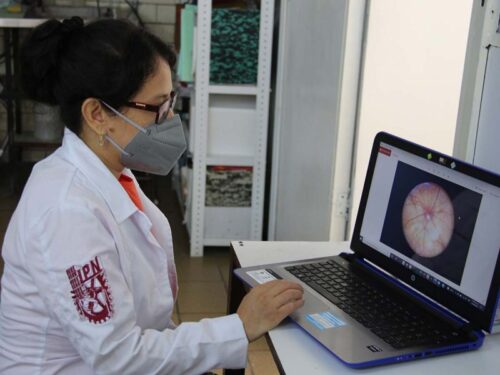
En tanto, la estudiante de doctorado Sandra Edith Cabrera Becerra, colaboradora del proyecto, refirió que la retinopatía proliferativa es la etapa más avanzada de la enfermedad y en ella se genera la neovascularización (nuevos vasos) debido al aumento de factores angiogénicos, como la proteína Angiopoyetina 2, la cual es posible disminuir mediante la degradación de su Ácido Ribonucleico mensajero (RNAm) al aplicar –vía intravítrea– los siRNAs, diseñados mediante herramientas bioinformáticas y sintetizados en el laboratorio. Especificó que para que el silenciamiento génico sea más efectivo al diseñar los siRNAs se utilizan todas las variantes y mediante diferentes programas se identifican las regiones susceptibles de silenciamiento. La joven investigadora precisó el efecto de la terapia de silenciamiento génico se valora mediante la técnica de fondo de ojo y el uso de programas informáticos, que determinan la cantidad de uniones que representa la formación de nuevos vasos y la lacunaridad (espacio libre de vasos en la retina). “En el modelo animal tratado con los siRNAs contabilizamos menor número de ramificaciones y un aumento de lacunaridad, en comparación con el grupo de ratas sin tratamiento”, expuso.
De acuerdo con los resultados obtenidos hasta el momento comprobaron que hay una relación intrínseca entre la sobreexpresión de la proteína Angiopoyetina 2 y un aumento de la neovascularización. La cuantificación de la expresión del mensajero de esta proteína fue determinada por medio de la técnica de Reacción en Cadena de Polimerasa (PCR). El doctor Villafaña Rauda destacó que por la aportación que representa en el desarrollo de medicamentos, este proyecto fue galardonado recientemente con el Premio “Santiago Maza”, otorgado por la Asociación Farmacéutica Mexicana. Actualmente se encuentra en proceso de elaboración el artículo que reportará el avance científico en una revista de prestigio internacional.